Antwoord:
Natuurlijke en menselijke gemaakte bronnen.
Uitleg:
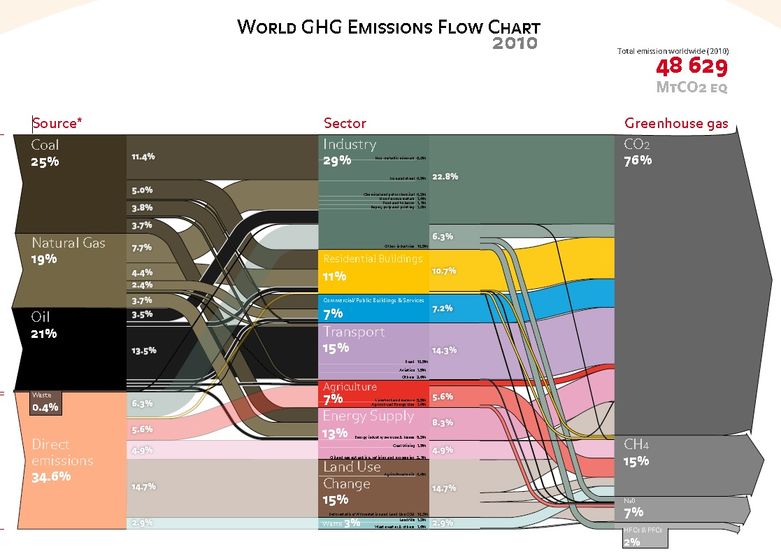
De belangrijkste natuurlijke broeikasgassen zijn CO2, CH4 (methaan) en N2O (lachgas). Vulkanen en bosbranden stoten grote hoeveelheden CO2 uit, terwijl rottende vegetatie grote hoeveelheden methaangas kan afgeven. Distikstofoxide-emissies komen van nature voor via vele bronnen die samenhangen met de stikstofcyclus, die de natuurlijke circulatie van stikstof is in de atmosfeer, planten, dieren en micro-organismen die in bodem en water leven (http://www3.epa.gov/climatechange/ ghgemissions / gassen / n2o.html)
Menselijke activiteiten die fossiele brandstoffen en brandende bossen verbranden, veroorzaken echter dat nog meer van deze belangrijke broeikasgassen zich opstapelen in de atmosfeer. CO2-bronnen zijn onder meer kolengestookte elektriciteitscentrales, raffinaderijen, oliebedrijven, cementfabrieken en miljoenen auto's, vrachtwagens en vliegtuigen. Menselijke bronnen van methaan zijn lekkende aardgaspijpleidingen en rijstvelden.
Mensen hebben ook "nieuwe broeikasgassen" in de atmosfeer gestopt, die nooit eerder hebben bestaan, zoals CFK's en HCFK's en SF6. Ook hebben deze broeikasgassen een verschillend aardopwarmingspotentieel (zie grafiek). Als CO2 een opwarmingspotentieel van 1 heeft, is methaan bijvoorbeeld ongeveer 25x krachtiger en SF6 is bijna 23.000X krachtiger dan CO2!

Waar of niet waar? + Voorbeeld

False Beschouw een tegenvoorbeeld: laat f (x) = x (x-1) op [3/4, 7/4]. Inderdaad, we hebben f '(x)! = 0 en f monotoon op dit interval, maar we nemen waar dat f (1) = 0. Dus de verklaring is onjuist.
Waar is de Amish een voorbeeld van? + Voorbeeld

Een religieuze minderheid De Amishes zijn een voorbeeld van een religieuze minderheid (oorspronkelijk Duits en Lutheranen) woonachtig in Pennsylvania. Ze weigeren zich aan te passen aan de moderne normen van technologie en de consumptiemaatschappij.
Wanneer komen dipolen voor in een molecuul? + Voorbeeld

Dipolen komen voor wanneer er een relatieve lading is aan elke zijde van een molecuul geïnduceerd door de elektronegelativiteiten van de binding. Het dipoolmoment van een volledig molecuul bestaat uit twee verbindingsmomenten - vectoren die zowel magnitude als richting hebben. Een gemeten dipoolmoment is dus gelijk aan de vectorsom van de verbindingsmomenten waaruit het bestaat. Bondmomenten zijn vectorgrootheden, die zowel magnitude als richting hebben. Daarom is het mogelijk dat een molecuul bindingsmomenten heeft en toch niet-polair is, als de individuele bindingsmomenten in het molecuul in grootte gelijk zijn maar
